Что такое кристаллическая сода — способы получения, применение

Карбонат натрия, известный как кальцинированная (это определение чаще звучит в быту) или кристаллическая сода, требует осторожности. Это вещество нельзя применять в кулинарии, как пищевую соду, но оно может служить для стирки, очистки, дезинфекции, отбеливания.
Кристаллическая сода — что это такое
Популярная кристаллическая сода, формула которой пишется как Na2CO3, представляет собой неорганическое соединение.

Эта натриевая соль слабой двухосновной уксусной кислоты известна под несколькими названиями. В химических учебниках это вещество обозначают как карбонат натрия. В быту при разнообразном применении чаще звучит наименование кальцинированная, реже кристаллическая сода.
Отличия от пищевой соды
Чтобы не нанести себе вреда при использовании, необходимо различать разные виды соды. В кулинарии применяют только питьевую (пищевую) соду. Ее химическое наименование — гидрокарбонат натрия. Формула соединения, которое также называют двууглекислым натрием, записывается как NaHCO3.

Достаточно агрессивную кристаллическую соду, у которой другая химическая формула (Na2CO3), опасно использовать в качестве пищевого продукта. При попадании в организм она может стать причиной аллергии, а на кожных покровах под воздействием кальцинированной соды развивается дерматит.
Есть не только структурное отличие карбоната натрия от пищевой соды. Сравнительный анализ представлен в таблице.
| Кристаллическая разновидность | Пищевая сода | |
| Основное химическое название вещества | Карбонат натрия | Гидрокарбонат натрия |
| Формула | Na2CO3 | NaHCO3 |
| Щелочная реакция, pH | 11 | 8 |
| Структура гранул | Рыхлая | Более жесткая |
| Способы хранения | Требуется герметичная упаковка | Можно держать в картонной коробке, оберегая от попадания влаги |
Химические свойства кристаллической соды
Если анализировать внешний вид карбоната натрия, это преимущественно белый порошок, хотя встречается форма бесцветных кристаллов. Вещество растворяется в воде и глицерине. Если размешивать кристаллическую соду в этаноле, проявляется низкая степень растворимости. Нужно учитывать, что в ацетоне, как и сероуглероде, карбонат натрия не растворяется.

Интересно! Как правильно пить соду по Неумывакину и схемы лечения от различных болезней
Это гигроскопичное вещество, которое легко поглощает из окружающей атмосферы углекислоту с водяным паром. В результате получается гидрокарбонат натрия.
Молекулярная масса кристаллической соды рассчитывается, ориентируясь на химическую формулу:
Mr(Na2CO3) = 23×2 + 12 + 16×3 = 106.
Если рассматривается безводная кристаллическая сода, то массовые доли всех входящих в состав элементов будут рассчитываться следующим образом:
Температура плавления карбоната натрия достаточно высокая. Она составляет +854 °C.
Плотность, рассчитываемая при +20 °C, равняется 2,53 г/см³.
Если в воде растворили кристаллическую соду, происходит реакция гидролиза. После ее завершения образуется нестойкая в химическом отношении угольная кислота H2CO3 (она быстро распадается на воду и CO2), выделяется NaOH. Благодаря этому гидроксиду натрия раствору обеспечивается щелочная реакция.
Способы получения кристаллической соды
В промышленности применяют разные способы получения гранулированного или порошкообразного карбоната натрия:
- Из водорослей. Эта технология предполагает сжигание водорослей и некоторых наземных растений. После промывания оставшейся золы получали щелочной раствор. Его выпаривали кипячением до сухого состояния. С XIX в. этот метод постепенно утратил свою актуальность.
- Из нефелиновой руды. Технология была разработана российскими учеными. Сырьем служит известняк и нефелиновый концентрат. После переработки получают несколько продуктов, включая кальцинированную соду.
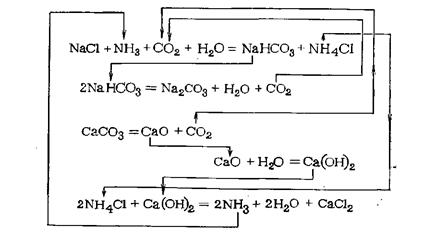
- Способ Сольве. Этот метод применяется с 1861 г. Сырьем выступает хлорид натрия (используют насыщенный раствор). Через него пропускают диоксид углерода совместно с газообразным аммиаком. Выпавший в осадок малорастворимый гидрокарбонат натрия фильтруют и нагревают до +140…+160 °C для обезвоживания. В результате получают карбонат натрия. Выделившийся углекислый газ снова включается в производственный процесс. После обработки хлорида аммония гидроксидом кальция остается хлорид кальция, который служит единственным побочным продуктом при выработке кристаллической соды. В настоящее время непосредственно по технологии Сольве производят до 84% мирового объема этого вещества.
- Способ Хоу. В качестве исходного сырья также берут хлорид натрия, нагретый до +40 °C. В него поступает аммиак одновременно с диоксидом углерода. В результате, аналогично методу Сольве, выпадает в осадок химическое соединение, известное как гидрокарбонат натрия. По технологии Хоу его охлаждают до +10 °C, что вызывает появление осадка хлорида аммония. Оставшийся раствор снова возвращается для повторного использования в производственном цикле.

Следовательно, в отличие от методики Сольве, побочным продуктом способа Хоу служит NH4Cl, то есть хлорид аммония, а не CaCl2 — хлорид кальция. Известно, что NH4Cl может служить в роли азотного удобрения. Но его сфера применения в этом направлении ограничена присутствием в структурной формуле хлора, чрезвычайно вредного для большинства культур.
С другой стороны, рис неплохо реагирует на хлор, поэтому в Китае хлорид аммония с успехом используется для подкормки этого вида злаков. Этим объясняется популярность именно в Китае способа Хоу, ориентированного на выработку кристаллической соды.
Кристаллическая сода в природе
Почти четверть всего мирового объема соды целенаправленно добывают из разнообразных природных источников. Встречается это вещество не только в золе ряда растений и водорослей (например, Salsola Soda), но и в форме минералов:

Минеральные содовые озера открыты в Забайкалье, на территории Западной Сибири, в Калифорнии, Танзании. Минерал трона входит в состав осадочной породы, обнаруженной в США (штат Вайоминг), добывается он также в Турции, Кении.
Техника безопасности при использовании кристаллической соды
Популярный карбонат натрия находит в промышленности применение в нескольких направлениях:

Нередко карбонат натрия в регламентируемых дозах встречается в роли пищевой добавки. Ее обозначение — E500. Служит для предупреждения слеживания продуктов и регулирования кислотности.
Входит кристаллическая разновидность соды в состав используемых в фотографии проявителей.
Бытовое применение:
При погружении в раствор кристаллической соды белых натуральных предметов одежды устраняются пятна, желтые разводы. Изделия становятся белоснежными.
Применяется кристаллическая сода, если вода из-за повышенной жесткости становится причиной появления накипи. Она результативно удаляет известковый налет.

Интересно! Как с помощью соды и мочи определить беременность
Используя многофункциональный карбонат натрия для бытовых целей, необходимо учитывать, что это химическое соединение относится к перечню веществ 3-го класса опасности. Если карбонат натрия растворили с последующим распылением, то предельно допустимая концентрация аэрозоли кристаллической соды в воздухе составляет 2 мг/м³.
Когда вещество контактирует с влажными кожными покровами, попадает в глаза или на слизистые покровы рта, носа, оно вызывает раздражение, покраснение. Если наблюдается длительное воздействие, то развивается дерматит.
При бытовом использовании универсальной кристаллической соды обязательно соблюдать технику безопасности:

Не используют агрессивную кальцинированную соду для очищения деревянных, алюминиевых, лакированных, окрашенных поверхностей. Требуется осторожность при стирке изделий из синтетических волокон.
Для хранения порошка с высокой степенью гигроскопичности отводят сухое место вдали от продуктов, недоступное детям и домашним животным. Емкость, куда ссыпается кристаллическая сода, необходимо закрывать герметичной крышкой.
Карбонат натрия или кристаллическая сода, известная в быту как кальцинированная, применяется в роли дезинфицирующего, очищающего, отбеливающего вещества. Учитывая возможность получения химических ожогов слизистых покровов, развития дерматита на кожных покровах, при использовании обязательно соблюдают рекомендуемые меры безопасности.







